
二维氢氧化钴纳米催化剂用于酒精性肝损伤的催化抗氧化治疗

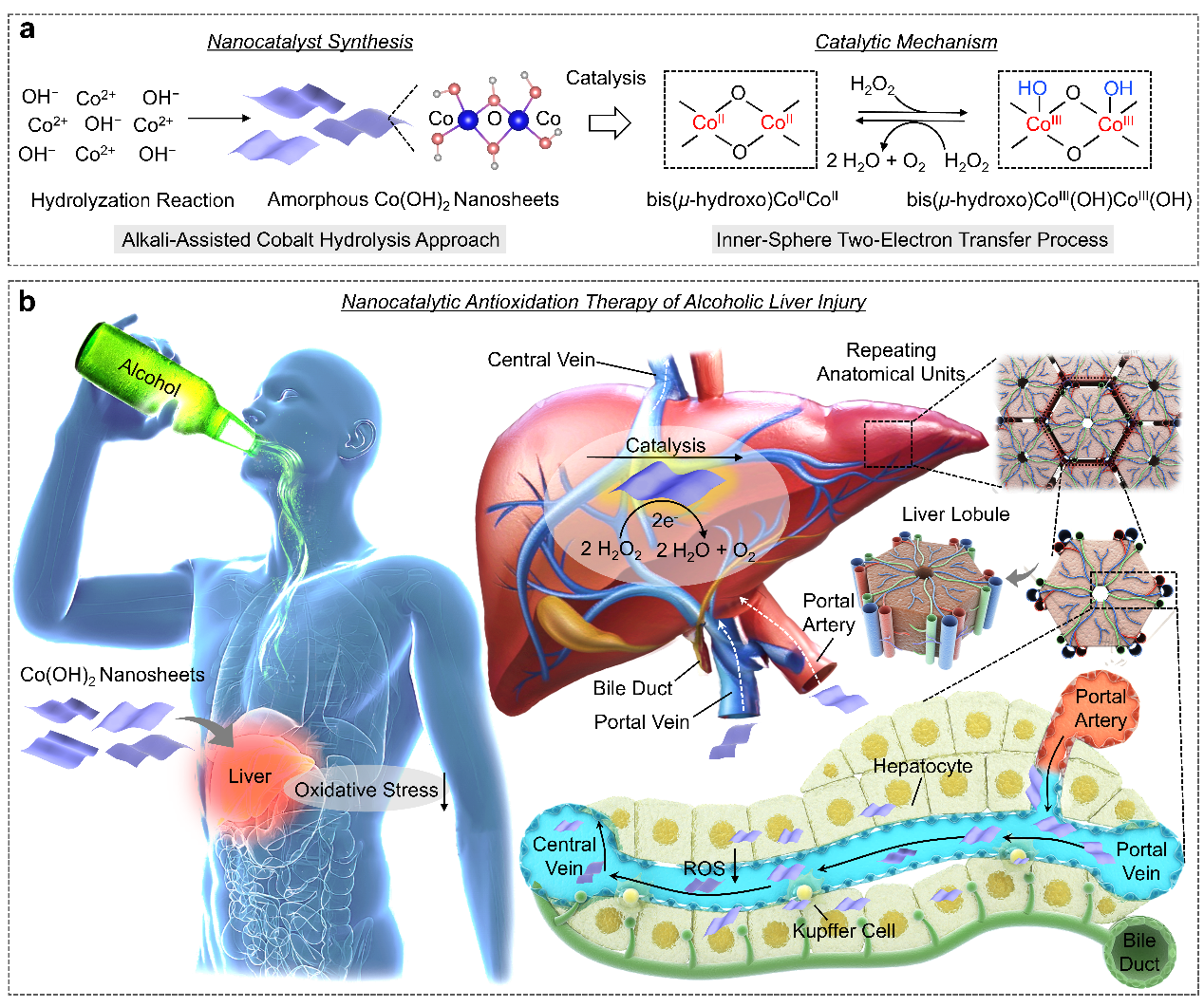
酒精性肝损伤(alcoholic liver injury, ALI)是一种由长期或过量酒精摄入引发的严重肝脏疾病,其主要病理机制是酒精代谢过程中产生的过量活性氧破坏了肝脏的氧化还原平衡。ROS的累积导致氧化应激,不仅直接导致肝细胞凋亡和铁死亡,还通过诱导Kupffer细胞(肝巨噬细胞)极化为促炎性M1表型,分泌大量促炎因子(如白介素6、白介素1β和肿瘤坏死因子α),加剧肝脏炎症反应。氧化应激如果得不到缓解,就会加速肝纤维化甚至肝硬化的发生。因此,及时清除肝脏病理环境内过表达的ROS,对于治疗ALI至关重要。由于纳米颗粒在血液输运过程中优先在肝脏内富集,因此可以构建具有抗氧化特性的纳米药物或纳米催化剂缓解肝脏氧化损伤。
近日,中国科学院上海硅酸盐研究所施剑林院士团队制备了一种不定型二维Co(OH)2纳米催化剂,该材料具有肝脏被动靶向能力以及催化抗氧化活性,在肝脏中具有高效且持续的ROS清除作用,用于ALI的催化抗氧化治疗。这种纳米催化剂通过一种简单的碱辅助水解策略制备,制备的无定型Co(OH)2纳米片厚度约为3 nm,横向尺寸约为100 nm,表现出显著的二维纳米片状特征。Co(OH)2纳米片具有CoIICoII双核活性位点和丰富的羟基,同时二维结构最大限度地暴露了活性中心,从而有利于H2O2的歧化反应,将其转化为H2O和O2,米氏动力学常数Km为59.31 mM,接近于天然过氧化氢酶。进一步的密度泛函理论(DFT)计算表明,该纳米催化剂通过Co(III)/Co(V)氧化还原循环和内球质子耦合双电子转移机制显著降低了H2O2分解反应的能垒,实现了高效的非缔合型催化循环。
在细胞水平,Co(OH)2纳米催化剂通过清除Kupffer细胞中的过量ROS,将Kupffer细胞的表型从促炎性的M1型转化为抗炎性的M2型,并有效抑制炎症因子的过量分泌。此外,该纳米催化剂对肝细胞具有保护作用,通过清除肝细胞内过表达的ROS,减少肝细胞内脂质过氧化物的生成,恢复肝细胞中谷胱甘肽(GSH)和谷胱甘肽过氧化物酶(GPx)的水平,从而显著减少由氧化应激引发的肝细胞凋亡和铁死亡,有效维持肝细胞的活性和功能完整性。在体内实验中,研究团队采用长期酒精饲养的小鼠模型模拟酒精性肝损伤的病理特征。通过尾静脉注射方式递送Co(OH)2纳米催化剂,纳米材料有效富集于肝脏区域且积累效率高达35.5% ID/g,在肝脏内滞留至少24小时。纳米催化剂显著缓解了肝脏组织中的氧化应激,抑制了肝细胞凋亡/铁死亡和Kupffer细胞的炎症转化。治疗组小鼠的存活率显著提高,与对照组相比,血清中谷丙转氨酶(ALT)和谷草转氨酶(AST)水平显著降低,表明肝功能得到了有效保护。此外,组织病理学分析显示,纳米催化剂治疗的小鼠肝组织损伤显著减轻,脂滴积聚明显减少,炎症浸润水平下降。
为了全面阐明Co(OH)2纳米催化剂在ALI治疗中的分子机制,研究团队结合转录组学分析评估了基因表达变化及其与关键信号通路的关联。通过RNA测序(RNA-seq)技术获取ALI模型组和Co(OH)2治疗组的小鼠肝脏组织基因表达谱,并进行差异表达基因分析。功能富集分析结果表明,ALI组显著富集于氧化还原过程、线粒体功能失调以及炎症相关的生物过程和分子功能,治疗组在上述功能中显现出恢复趋势,尤其是在氧化还原平衡和炎症因子的调控方面,表明Co(OH)2纳米催化剂对ALI的治疗机制主要涉及抗氧化和抗炎作用。通路富集分析和基因集富集分析结果进一步证实了纳米催化剂在氧化应激调控和炎症缓解中的关键作用,从而实现了肝脏保护效果。

活体水平Co(OH)2纳米材料对ALI的治疗效果
该研究工作以“Antioxidative Therapy of Alcoholic Liver Injury by an Amorphous Two-Dimensional Cobalt Hydroxide Nanocatalyst”为题发表在Angewandte Chemie International Edition上(2025,64,e202412031,DOI:10.1002/anie.202412031)。第一作者为2023级博士生姜迪,通讯作者为杨博文副研究员,研究工作得到了施剑林院士的悉心指导。研究工作得到了国家重点研发计划、国家自然科学基金、上海市启明星项目的资助和支持。
论文链接:https://doi.org/10.1002/anie.202412031

