
基于仿生Co纳米催化剂的主动脉夹层催化抗氧化治疗

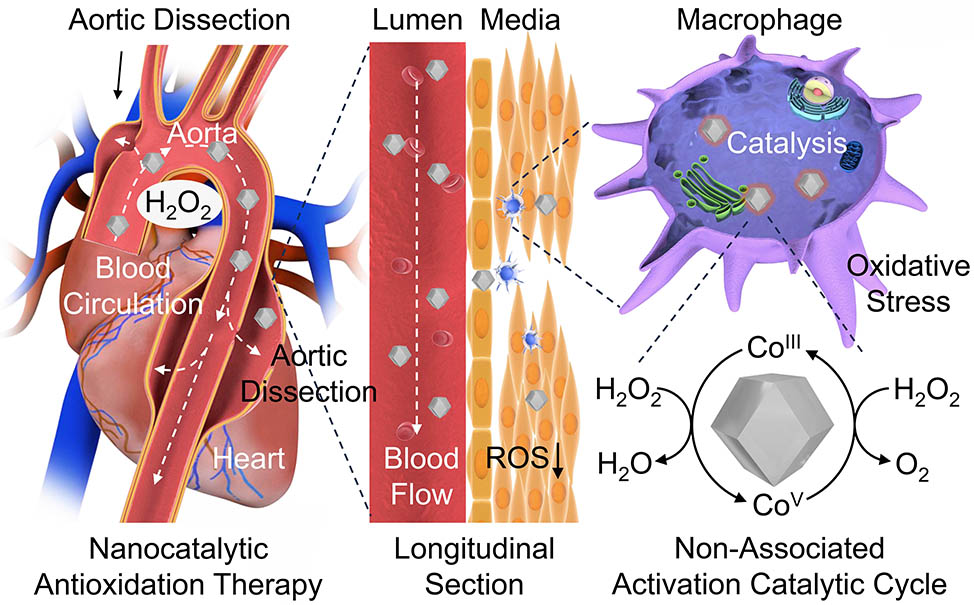
主动脉夹层是致死率最高的心血管疾病之一。由于主动脉区域活性氧过度表达,导致氧化应激,进一步促进主动脉区域的巨噬细胞极化为促炎性的M1表型,分泌各种促炎因子,如白介素6、白介素1β、肿瘤坏死因子α等,导致主动脉炎症,进一步可以影响主动脉各种功能细胞,如血管平滑肌细胞,导致其凋亡或铁死亡,最终使主动脉发生形态上的变化,增加病人因主动脉破裂的猝死风险。因此,清除主动脉区域的活性氧,有望延缓主动脉夹层这一致命性疾病的进展。
中国科学院上海硅酸盐研究所施剑林院士团队与复旦大学附属中山医院王立新团队合作,构建具有仿生结构的Co纳米催化剂,在主动脉区域引发纳米催化抗氧化反应,用于主动脉夹层的治疗。基于“化学同源”思想,利用配位反应,在甲醇中将Zn2+、Co2+与二甲基咪唑反应,使Co2+掺杂在沸石咪唑骨架材料ZIF-8中,形成具有Co-N4配位结构的纳米催化剂。这种纳米催化剂粒径约为200nm,具有六角双锥体结构。由于材料的Co-N4配位结构和天然过氧化氢酶的配位结构(Fe-N4结构)相似,因此具有类似过氧化氢酶的催化活性,可以引发歧化反应将H2O2转变为O2和H2O。通过米氏动力学分析表明材料的米氏动力学常数Km为56.921 mM,表现出非常好的催化活性。理论计算表明纳米催化剂可以通过羟基钴(III)和氧-羟基钴(V)转变和内球质子耦合二电子转移促进H2O2歧化为O2和H2O,形成非缔合活化催化循环。
在细胞水平,纳米催化剂可以通过清除巨噬细胞中的活性氧调控表型转变,使其由促炎性的M1型转变为抗炎性的M2型,缓解炎症。为了深入了解纳米催化剂在巨噬细胞中潜在的氧化还原调控机制以及相关的细胞通路,对Raw 264.7细胞进行了高通量RNA测序。基因本体分析显示基因富集与离子通道活性、底物特异性通道活性以及离子跨膜转运相关,而KEGG分析进一步表明,上调基因富集于磷酸肌醇3-激酶-akt(PI3K-Akt)信号通路,与前人研究一致。进一步发现,在PI3K-Akt通路的上调基因中,DNA损伤诱导转录本4(DDIT4)基因表现出显著差异(Log2FC = 4.6116),表明DDIT4参与巨噬细胞的氧化还原调节。通过transwell小室实验进一步表明,材料可以通过抗炎进一步保护血管平滑肌细胞,减少凋亡,保持血管平滑肌细胞的活性和功能。
在活体水平,利用β-氨基丙腈(BAPN)在小鼠上建立主动脉夹层动物模型。将含有纳米催化剂的PBS通过尾静脉注射到小鼠体内,24小时内纳米颗粒可以在主动脉夹层区域有效富集。给药之后,小鼠体重变化不明显,存活率提高,主动脉夹层的发生减少。超声图像也表明BAPN处理的小鼠的主动脉弓增大,主动脉瘤形成,而纳米催化剂可以缓解主动脉瘤的扩张,延缓主动脉夹层的进展。免疫组织化学染色,包括H&E,EVG,Masson,抗α-平滑肌肌动蛋白(α-SMA)和OPN,显示在BAPN处理的小鼠中有明显的内膜撕裂,弹性纤维降解,胶原沉积和血管平滑肌细胞表型转变。纳米催化剂改善了主动脉夹层的症状,并保持了主动脉的结构完整性。免疫荧光染色显示,主动脉夹层组织中CD86+F4/80+巨噬细胞(M1型巨噬细胞)浸润增强,CD206+F4/80+巨噬细胞(M2型巨噬细胞)浸润受限,表明主动脉夹层区域炎症明显。值得注意的是,仿生Co纳米催化剂抑制了M1型巨噬细胞的浸润,同时促进了M2型巨噬细胞的浸润,具有良好的抗炎作用。
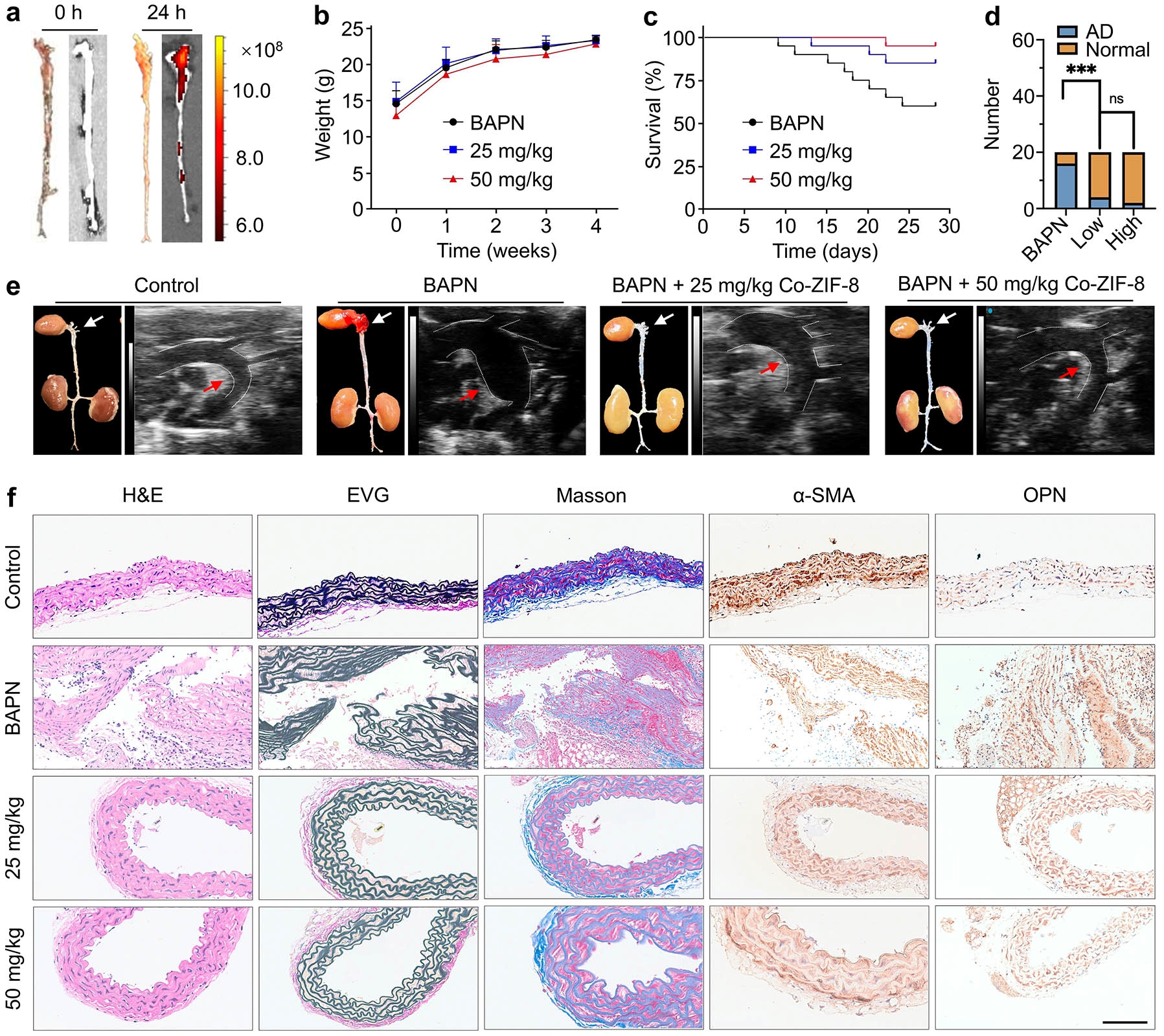
活体水平仿生Co纳米催化剂对主动脉夹层进展的抑制效果
该研究工作以“Biomimetic-Structured Cobalt Nanocatalyst Suppresses Aortic Dis-section Progression by Catalytic Antioxidation”为题发表在Journal of the American Chemical Society上(J. Am. Chem. Soc.2024,146, 17201−17210,DOI: 10.1021/jacs.4c03344)。第一作者为上海硅酸盐研究所杨博文副研究员、中山医院胡诚凯和张宇翀,通讯作者为施剑林院士和王立新。研究工作得到了国家自然科学基金等项目的资助和支持。
论文链接:https://doi.org/10.1021/jacs.4c03344

