
上海硅酸盐所在基于蒙脱石的口服黏膜肿瘤疫苗研究中取得重要进展

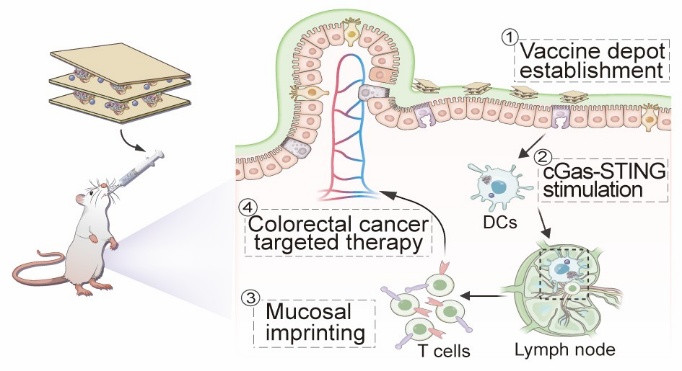
结直肠癌是全球高发的黏膜来源恶性肿瘤之一,因其发生部位特殊、免疫屏障复杂,传统注射疫苗常难以有效激活肠道黏膜免疫,导致免疫防护效果有限。近年来,靶向黏膜免疫系统的肿瘤疫苗研究成为国际前沿,尤其是基于口服途径的疫苗设计,因其可直接作用于肠道黏膜并激发局部免疫,展现出广阔应用前景。
团队选用蒙脱石这种具有良好胃肠耐受性和天然黏膜粘附能力的二维层状材料为载体,采用离子交换策略将免疫增强剂Mn2+和模型肿瘤抗原OVA共同负载于其层间,成功构建出稳定的口服疫苗平台Mn-MMT@OVA。经口服给药后,该疫苗可在胃肠环境中保持结构稳定,进入小肠后紧密附着于肠黏膜形成“疫苗接种库”,实现抗原与免疫佐剂的持续释放。释放出的Mn2+可显著激活树突状细胞中的cGAS-STING通路,诱导树突细胞成熟并促进其向肠系膜淋巴结迁移,进一步激活黏膜特异性的T细胞免疫响应(图1)。该研究在抗肿瘤免疫实验中证明,Mn-MMT@OVA不仅可在小肠及相关黏膜组织中诱导高水平的抗原特异性IgA分泌,同时在结肠肿瘤微环境中促进CD8⁺细胞毒性T淋巴细胞的高效浸润。此外,Mn-MMT@OVA疫苗还可有效重塑肠道免疫微环境,显著下调IL-10、TGF-β等免疫抑制因子表达水平,增强抗肿瘤免疫活性。Mn-MMT@OVA口服疫苗表现出优异的抗肿瘤疗效和良好的生物相容性。进一步对比不同给药途径的疗效发现,Mn-MMT@OVA仅在口服条件下展现出显著的肿瘤抑制作用,凸显了“黏膜免疫印记”在黏膜肿瘤治疗中的关键价值(图2)。该项研究将具有层间负载能力的天然矿物材料应用于黏膜疫苗开发,结合免疫活性金属离子的协同效应,建立了一种高效、稳定、可口服的肿瘤疫苗递送系统,为结直肠癌及其他高发黏膜癌症和传染性黏膜疾病的疫苗开发提供了候选策略。
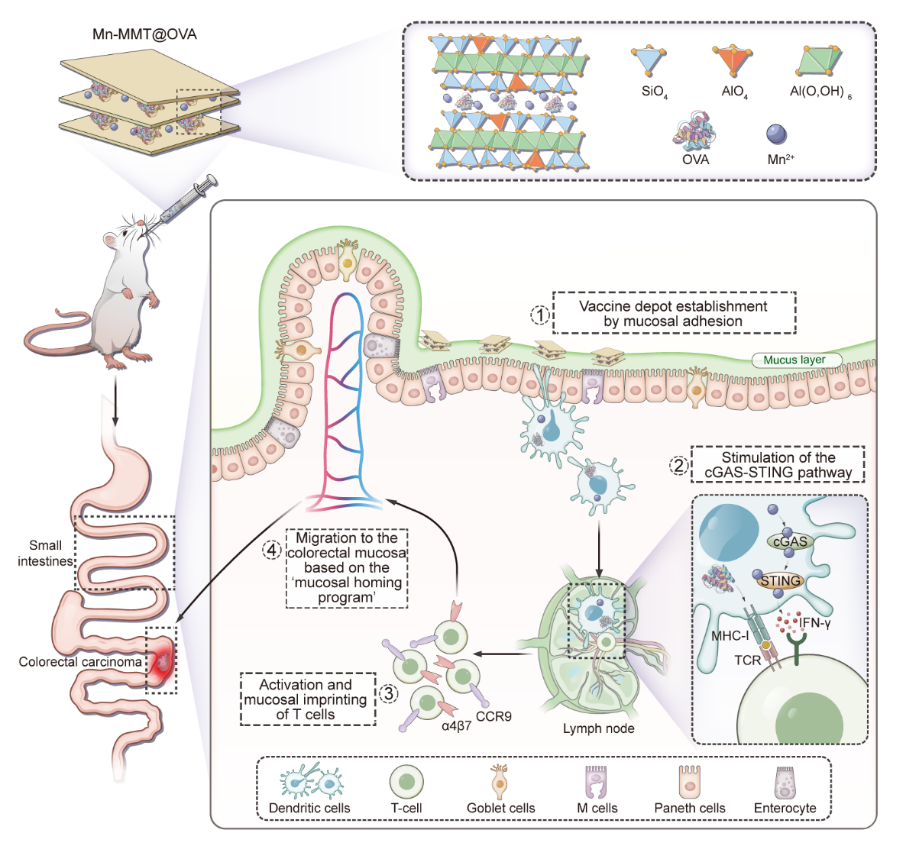
图1. 基于蒙脱石纳米片黏膜疫苗(Mn-MMT@OVA)的抗肿瘤免疫治疗示意图
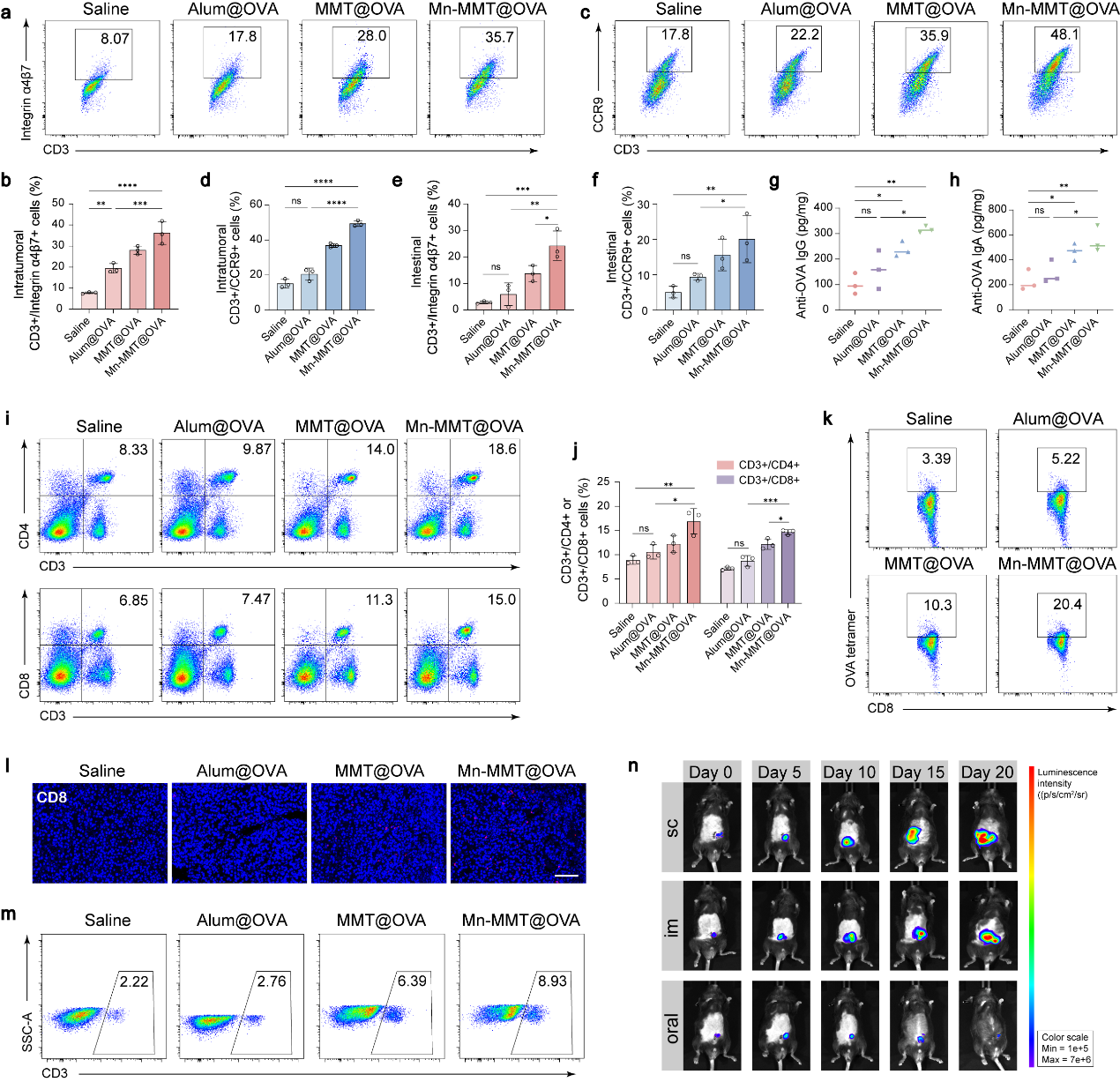
图2. Mn-MMT@OVA有效诱导黏膜免疫应答及发挥抗肿瘤作用
该研究工作以“Montmorillonite-based oral vaccine for colorectal cancer immuno-therapy through mucosal immune activation”为题发表在Journal of the American Chemical Society上 (J. Am. Chem. Soc. 2025, 147, 21170−21183, DOI: 10.1021/jacs.5c06776)。第一作者为上海市第十人民医院博士后杨捷,通讯作者为上海硅酸盐所林翰副研究员和施剑林研究员。该研究工作得到了国家自然科学基金、中国科学院战略性先导科技专项(B类)、中国医学科学院医学与健康科技创新工程、上海市“科技创新行动计划”、中国博士后基金等项目的联合支持。
论文链接:https://pubs.acs.org/doi/10.1021/jacs.5c06776

